無水クエン酸の量はいくらか 106回薬剤師国家試験問92
106回薬剤師国家試験 問92
調製した1mol/L水酸化ナトリウム液を標定した結果、ファクターは、1.025であった。
日本薬局方無水クエン酸(C6H8O7:192.12、下図)適量を水50mLに溶かし、この標準液を用いて滴定した結果、滴定量は7.85mL であった(指示薬:フェノールフタレイン試液1滴)。
この時、無水クエン酸の量(mg)はいくらか。1つ選びなさい。

106回薬剤師国家試験 問92 解答解説

本定量法は、クエン酸と水酸化ナトリウムの酸塩基反応を定量に利用する
酸塩基滴定(中和滴定)である。
まず、1mol/L水酸化ナトリウム液の無水クエン酸の対応量を計算する。
構造式より、クエン酸は3つのカルボキシ基を持つ。
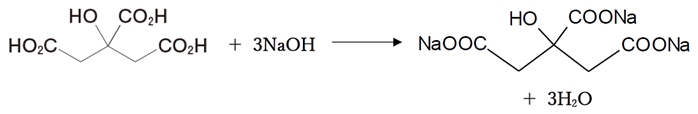
よって、クエン酸と水酸化ナトリウムはモル比1:3で反応する。
これに基づき、
1mol/L水酸化ナトリウム液1mLの無水クエン酸の対応量を求める。
1mol/L水酸化ナトリウム液1mLに含まれる水酸化ナトリウムは1mmolである。
1mmolの水酸化ナトリウムは1/3×1mmolの無水クエン酸に対応する。
本問では無水クエン酸の分子量を192.12とするので、
1/3×1mmolの無水クエン酸の質量は、
1/3×1mmol×192.12 (g/mol) = 64.04mg
したがって、
1mol/L水酸化ナトリウム液1mLの無水クエン酸の対応量は下記の通り。
1mol/L水酸化ナトリウム液 = 64.04mg 無水クエン酸
1mol/L水酸化ナトリウム液の消費量をVmL,
水酸化ナトリウム液のファクターをfとすると、
試料中の無水クエン酸の含有量(mg)は下記の計算式で求められる。
無水クエン酸の含有量(mg) = 対応量(mg)×f×V(mL)
無水クエン酸の含有量(mg) = 64.04×1.025×7.85 = 515.28
★ 捕捉:式による対応量の計算
対応量(mg)は下記の計算式を用いても計算できる。

本問では、クエン酸と水酸化ナトリウムの反応について、
クエン酸(目的成分)の化学当量は1、
水酸化ナトリウム(標準液の成分)の化学当量は3である。
水酸化ナトリウム液の濃度は1mol/L、
無水クエン酸の分子量は192.12であるので、
対応量(mg)は式を用いて下記のように計算できる。

★ 他サイトさんの解説リンク
106回問92(e-RECさん)