中和滴定 次の滴定と予測される滴定曲線 91回薬剤師国家試験問17
91回薬剤師国家試験 問17
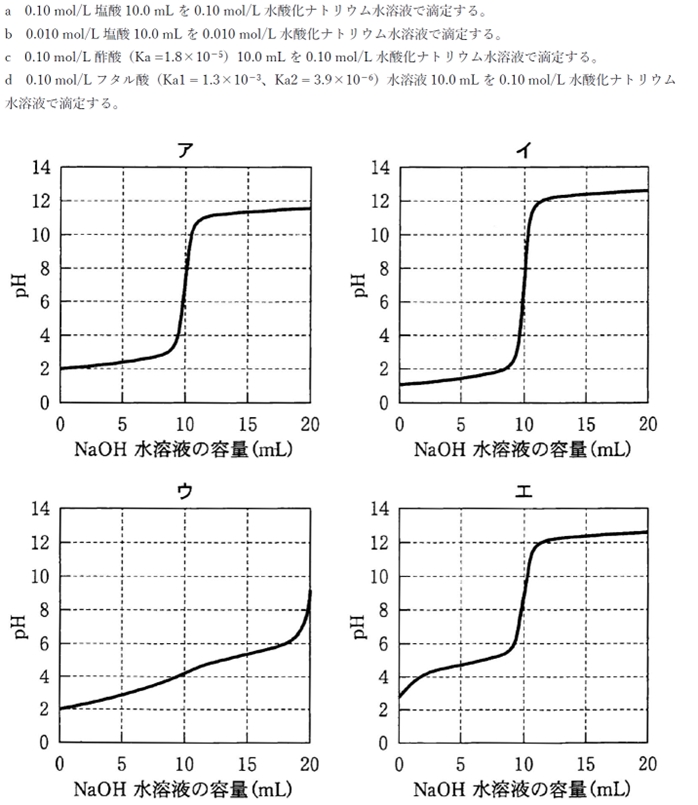
次の滴定(a〜d)と予測される滴定曲線(ア〜エ)を正しく組み合わせなさい。
91回薬剤師国家試験 問17 解答解説
◆ aについて
a 0.10 mol/L塩酸10.0 mLを0.10 mol/L水酸化ナトリウム水溶液で滴定する。
イの滴定曲線が該当する。

・滴定開始前のpHについて
0.10 mol/L塩酸なので滴定開始前のpH=1.0だと考えられる。
・当量点について
1価の強酸を1価の強塩基で滴定しており、両者の濃度が等しい。
よって、当量点付近でpH飛躍が見られ、
当量点について、pHは7付近で、
消費した水酸化ナトリウム水溶液の容量は塩酸の量に等しい10mLになると考えられる。
・当量点後
0.10 mol/L水酸化ナトリウム水溶液で滴定したため、
当量点後は水酸化ナトリウム水溶液の滴加量が増えるに従いpHは13に近づくと考えられる。
◆ bについて
b 0.010 mol/L塩酸10.0 mLを0.010 mol/L水酸化ナトリウム水溶液で滴定する。
アの滴定曲線が該当する。

・滴定開始前のpHについて
0.010 mol/L塩酸なので滴定開始前のpH=2.0だと考えられる。
・当量点について
1価の強酸を1価の強塩基で滴定しており、両者の濃度が等しい。
よって、当量点付近でpH飛躍が見られ、
当量点について、pHは7付近で、
消費した水酸化ナトリウム水溶液の容量は塩酸の量に等しい10mLになると考えられる。
・当量点後
0.010 mol/L水酸化ナトリウム水溶液で滴定したため、
当量点後は水酸化ナトリウム水溶液の滴加量が増えるに従いpHは12に近づくと考えられる。
◆ cについて
c 0.10 mol/L酢酸(Ka =1.8×10-5)10.0 mLを0.10 mol/L水酸化ナトリウム水溶液で滴定する。
エの滴定曲線が該当する。

・当量点について
1価の弱酸を1価の強塩基で滴定しているので、
当量点付近で比較的に小さいpH飛躍が見られ、
弱酸と強塩基から生成する塩は弱塩基性を示すので、当量点のpHは塩基性である。
酢酸と水酸化ナトリウムの濃度は等しいので、
消費した水酸化ナトリウム水溶液の容量は酢酸溶液の量に等しい10mLになると考えられる。
中和滴定において、
酸の酸性が弱いほど、または、
塩基の塩基性が弱いほど、
pHジャンプは小さくなる。
・当量点後
0.10 mol/L水酸化ナトリウム水溶液で滴定したため、
当量点後は水酸化ナトリウム水溶液の滴加量が増えるに従いpHは13に近づくと考えられる。
◆ dについて
d 0.10 mol/Lフタル酸(Ka1 = 1.3×10-3、Ka2 = 3.9×10-6)水溶液10.0 mLを0.10 mol/L水酸化ナトリウム水溶液で滴定する。
ウの滴定曲線が該当する。

フタル酸は酸性の解離基であるカルボキシ基を2つ持つが、
Ka1とKa2の差が小さいので、
第一当量点のpH飛躍は見られないと考えられる。
pKa1とpKa2の差が4以上でないと、
明瞭なpHジャンプは見られない。
よって、第一当量点について、
フタル酸と水酸化ナトリウムの濃度は等しいので、
NaOH溶液の滴加量がフタル酸溶液の量に等しい10mLになると第一当量点を迎えるが、
ここでのpH飛躍はない。
NaOH溶液の滴加量が20mLになると第二当量点を迎える。
第二当量点において、フタル酸のKa2は小さいので、小さいpH飛躍が見られ、
弱酸と強塩基から生成する塩は弱塩基性を示すので、当量点のpHは塩基性である。