96回薬剤師国家試験問32 D-ソルビトールの定量法
96回薬剤師国家試験 問32
日本薬局方D-ソルビトール(C6H14O6:182.17)の定量法に関する記述について、
本品を乾燥し、その約 0.2 gを精密に量り、水に溶かし、正確に100 mLとする。この液10 mLを正確に量り、ヨウ素瓶に入れ、過ヨウ素酸カリウム試液50 mLを正確に加え、水浴中で15分間加熱する。冷後、ヨウ化カリウム2.5 gを加え、直ちに密栓してよく振り混ぜ、暗所に5分間放置した後、遊離したヨウ素を0.1 mol/Lチオ硫酸ナトリウム液で滴定する(指示薬:デンプン試液3 mL)。同様の方法で空試験を行う。
この滴定において、D-ソルビトール、過ヨウ素酸、ヨウ素酸は下記のように反応する。

[ ]の中に入れるべき数値はどれか。
1 1.822
2 2.277
3 3.643
4 18.22
5 22.77
6 36.43
96回薬剤師国家試験 問32 解答解説
正解は1の1.822である。
0.1 mol/Lチオ硫酸ナトリウム液1 mL = 1.822mg C6H14O6
本問の定量法は、酸化還元平衡をD-ソルビトールの定量に利用する酸化還元滴定の逆滴定である。
反応の流れは下記の通り。
過ヨウ素酸を1,2-ジオールに対して反応させると、
下記のように過ヨウ素酸イオン(IO4-)が1,2-ジオールを酸化的に開裂させる。

D-ソルビトールはD-グルコースを還元して得られる糖アルコールである。
1つのD-ソルビトールは5箇所の1,2ジオールを有し、
それに対して5つの過ヨウ素酸イオン(IO4-)が反応して酸化的に開裂させ、
2つのホルムアルデヒドと4つのギ酸が生成する。
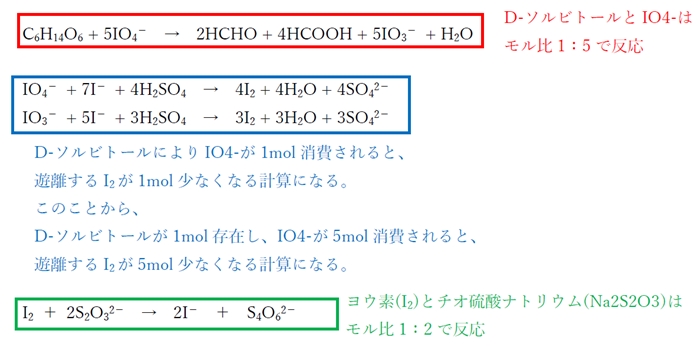
C6H14O6 + 5IO4- → 2HCHO + 4HCOOH + 5IO3- + H2O
…(1)
この反応は、過ヨウ素酸イオン(IO4-)を酸化剤、D-ソルビトールを還元剤とする酸化還元反応である。
この反応で、1molのD-ソルビトールに対して5molの過ヨウ素酸イオン(IO4-)が反応する。
反応後、ヨウ化カリウム(KI)を加え、
過ヨウ素酸イオン(IO4-)およびヨウ素酸イオン(IO3-)と
ヨウ化物イオン(I-)を反応させ、
ヨウ素(I2)を遊離させる。
反応式は下記の通り。
IO4- + 7I- + 4H2SO4 → 4I2 + 4H2O + 4SO4 2- …(2)
IO3- + 5I- + 3H2SO4 → 3I2 + 3H2O + 3SO4 2- …(3)
(1)(2)(3)の反応式より、
D-ソルビトールによりIO4-が1mol消費されると、
遊離するI2が1mol少なくなることを意味する。
遊離したヨウ素(I2)をチオ硫酸ナトリウム液(Na2S2O3)で滴定する。
I2 + 2 S2O3 2- → 2I- + S4O6 2-
この反応は、ヨウ素(I2)を酸化剤、チオ硫酸イオン(S2O3 2-)を還元剤とする酸化還元反応である。
この反応で、1molのI2に対して2molのNa2S2O3が反応する。
チオ硫酸ナトリウム液とD-ソルビトールの対応関係は下記のように考えられる。
したがって、
D-ソルビトールが1mol存在すると、
10molのチオ硫酸ナトリウムが消費される計算となる。
(D-ソルビトールとチオ硫酸ナトリウムは、モル比1:10で対応)
以上より、
0.1 mol/Lチオ硫酸ナトリウム液1 mLのD-ソルビトールの対応量は下記のように求められる。
0.1mol/Lチオ硫酸ナトリウム液1mLに含まれるチオ硫酸ナトリウムは0.1mmolである。
D-ソルビトールとチオ硫酸ナトリウムは1:10で対応するため、
0.1mmolのチオ硫酸ナトリウムは0.01mmolのD-ソルビトールに対応する。
本問ではD-ソルビトールの分子量を182.17とするので、
0.01mmolのD-ソルビトールの質量は、
0.01mmol×182.17 (g/mol)≒ 1.822mg
したがって、
0.1 mol/Lチオ硫酸ナトリウム液1mLに対するD-ソルビトールの対応量は下記の通り。
0.1 mol/Lチオ硫酸ナトリウム液1 mL = 1.822mg C6H14O6
★ 別解:式による対応量の計算
対応量(mg)は下記の計算式を応用しても計算できる。

本問では、
D-ソルビトールとチオ硫酸ナトリウムは、
モル比1:10で対応する。
チオ硫酸ナトリウム液の濃度は0.1mol/L、
アスピリンの分子量は182.17であるので、
対応量(mg)は式を用いて下記のように計算できる。
