アミノ安息香酸エチルの合成法 96回薬剤師国家試験問13
第96回薬剤師国家試験 問13
図は日本薬局方医薬品アミノ安息香酸エチルの合成法を示したものである。この合成法に関する記述の正誤を判定してみよう。
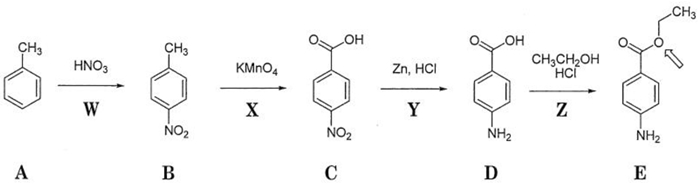
a 反応Wは、ベンゼン環に対するニトロ基の付加反応である。
b 化合物Bは、ニトロベンゼンをAlCl3 存在下、塩化メチルで処理しても合成できる。
c 反応X は酸化反応であり、反応Yは還元反応である。
d 反応Zは、SN2 反応の機構で進行する。
e 化合物Eの矢印で示した酸素原子は、エタノール由来である。
第96回薬剤師国家試験 問13 解答解説
◆ aについて

a × 反応Wは、ベンゼン環に対するニトロ基の付加反応である。
→ 〇 反応Wは、ベンゼン環に対するニトロ基の求電子置換反応である。
詳細は下記のリンク先を参照
96回問13a
◆ bについて

b × 化合物Bは、ニトロベンゼンをAlCl3 存在下、塩化メチルで処理しても合成できる。
bの記述は、ニトロベンゼンを基質とし、芳香族求電子置換反応のフリーデル・クラフツ アルキル化反応でメチル化しようという試みである。
しかし、ニトロベンゼンは、ニトロ基の強力な電子求引性電子効果によりベンゼン環の電子密度が低下しているため、求電子置換反応が起こりにくい。
また、ニトロ基が置換するベンゼン環は芳香族求電子置換反応においてメタ配向性を示すため、反応が起こってもメタ位が優先して置換されることになる。
詳細は下記のリンク先を参照
ニトロベンゼンのメタ配向性と反応性 85回問13d
◆ cについて

c 〇 反応X は酸化反応であり、反応Yは還元反応である。
過マンガン酸カリウム(KMnO4)は酸化剤であり、
反応Xではベンジル位が酸化されてCOOHとなる。
亜鉛は還元剤であり、
反応Yではニトロ基が還元されてアミノ基となる。

★ 有機化学における酸化・還元
有機化学における酸化とは、
ある原子(通常は炭素)の電子密度が低下する反応を指す。
その原子よりも相対的に電気陰性度が大きい原子との結合が形成される場合は酸化であり、
例として、炭素に酸素・窒素・ハロゲンが結合することは酸化である。
また、その原子よりも電気陰性度が小さい原子との結合が切れる場合も酸化に該当し、
炭素−水素の結合が切れることは酸化である。
有機化学における還元とは、
ある原子(通常は炭素)の電子密度が上昇する反応を指す。
その原子よりも相対的に電気陰性度が小さい原子との結合が形成される場合は還元であり、
例として、炭素−水素の結合が形成されることは還元である。
また、その原子よりも電気陰性度が大きい原子との結合が切れる場合も還元に該当し、
炭素と酸素・窒素・ハロゲンとの結合が切れることは還元である。
◆ dおよびeについて

d × 反応Zは、SN2 反応の機構で進行する。
→ 〇 反応Zは、求核付加−脱離反応の機構(求核アシル置換反応)で進行する。
e ○ 化合物Eの矢印で示した酸素原子は、エタノール由来である。
反応Zは、
カルボン酸を基質とする求核付加−脱離反応(求核アシル置換反応)である。
カルボン酸の求核アシル置換反応については下記のリンク先を参照
カルボン酸・カルボン酸誘導体の求核アシル置換反応の反応機構の概要
設問の反応Zは、
カルボン酸の求核アシル置換反応の1種であるフィッシャーのエステル合成である。

フィッシャーのエステル合成については下記のリンク先を参照
カルボン酸とアルコールでエステル生成(フィッシャーのエステル合成) 88回問12ab
設問の反応Zは下記のように進む。

なお、SN2反応は基質に求核剤が付加すると同時に脱離基が脱離するという一段階で済む反応である。
下記にSN2反応の概観を示す。
