エポキシドの開環の反応機構 酸性と塩基性での違い
本ページでは、エポキシド(オキシラン)の開環の反応機構について、
酸性条件下と塩基性条件下でそれぞれ説明しています。
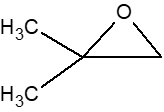
下記のエポキシド(オキシラン)を例に、
開環反応の機構を、
酸性条件と塩基性条件とで分けて説明する。
★ エポキシド(オキシラン)の酸性条件下での開環反応では、アルキル置換基の数がより多い方の炭素がCδ+となり、このCδ+が求核攻撃を受ける。
エポキシド(オキシラン)は、酸素が2つの炭素と結合し、三員環となっている。
酸性条件下、酸触媒の働きでオキシランの酸素がプロトン化されてO+となると、O+が共有電子対をより強く引き付けるようになり、O+に結合する炭素は大きく正に分極し、Cδ+となり、求核剤と反応しやすくなる。
この時、エポキシドのO+に結合する2つの炭素のうち、アルキル置換基の数がより多い方の炭素がCδ+となる方がより安定である。
以下の例では、BよりAの状態の方が安定なので、主にAの状態を経由して反応が進む。
と酸触媒の反応.jpg)
エポキシドの酸性条件下での開環反応では、主にアルキル置換基の数がより多い方の炭素がCδ+となる状態を経由し、このCδ+が求核剤の攻撃を受けて開環する。
エポキシドのCδ+に求核剤(Nu)が反応して付加する。この時、求核剤がCδ+にアクセスする経路として、エポキシドの酸素のいない側からの方がアクセスしやすい。
よって、求核剤(Nu)は、主に酸素のいない側からCδ+にアクセスする。このことから、エポキシドの開環後の主生成物は、OHとNuがanti付加(trans付加)したものとなる。
の酸性条件下での開環反応.jpg)
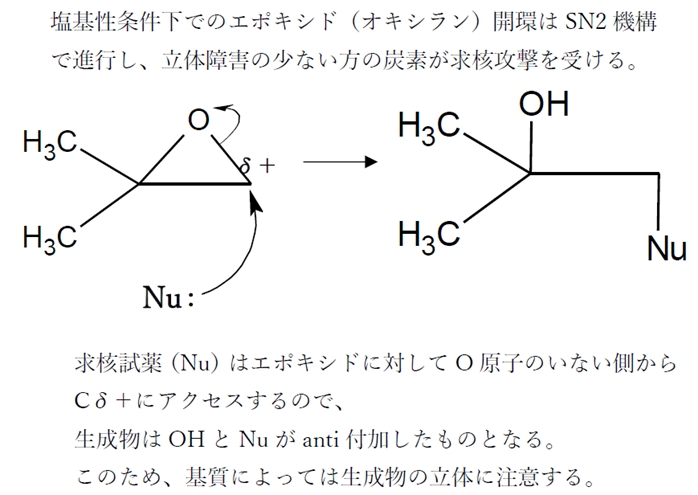
★ エポキシド(オキシラン)の塩基性条件下での開環反応では、SN2の機構で進み、アルキル置換基の数が少ない方の炭素が求核攻撃を受ける。
塩基性条件下でのエポキシド(オキシラン)の開環反応は、SN2反応の機構で進行する。
エポキシドの三員環を構成する2つの炭素のうち、置換基がより少なく、立体障害が小さい方の炭素が求核剤(Nu)の攻撃を受け、付加すると同時に炭素−酸素の結合が切れて開環する。
また、求核剤がエポキシドの炭素にアクセスする経路として、エポキシドの酸素のいない側からの方がアクセスしやすい。
よって、求核剤(Nu)は、主に酸素のいない側から炭素にアクセスする。このことから、エポキシドの開環後の主生成物は、OHとNuがanti付加(trans付加)したものとなる。