88回薬剤師国家試験問23 反応速度論 0次、1次、2次の特徴
88回薬剤師国家試験 問23
3種類の薬物A、B及びCの分解は、それぞれ0次、1次及び2次反応に従う。次の記述のうち、正しいものはどれか。
a Aの残存量は、時間と共に直線的に減少する。
b Bの残存量の対数は、時間と共に直線的に減少する。
c Cの残存量の逆数の対数は、時間と共に直線的に増加する。
d いずれの薬物も、その初濃度と半減期が同じ場合、半減期以降での薬物の分解量の最も少ないのはAである。
88回薬剤師国家試験 問23 解答解説
◆ aについて
a 〇 Aの残存量は、時間と共に直線的に減少する。
薬物Aの分解は0次反応に従う。
0次反応の特徴は下記のリンク先を参照
0次反応とは 速度式,半減期,グラフ
分解が0次反応に従う薬物の濃度(または含量)と時間の関係式として、
次式が成り立つ。
C = C0 - k0・t …①
C:時間tでの反応物の濃度(含量) C 0:初期の反応物の濃度(初期含量)
k0:0次反応速度定数
①式より、反応が0次反応に従う場合、
時間に対して反応物の濃度(含量)をプロットすると、
傾きが-k0の右下がりの直線が得られる。

◆ bについて
b 〇 Bの残存量の対数は、時間と共に直線的に減少する。
薬物Bの分解は1次反応に従う。
1次反応の特徴は下記のリンク先を参照
1次反応とは 速度式,半減期,グラフ
分解が1次反応に従う薬物の濃度(または含量)の自然対数と時間の関係式として、
次式が成り立つ。
lnC = lnC0 - k1・t …②
C:時間tでの反応物の濃度(含量) C0:反応物の初濃度(初期含量)
k1:一次反応速度定数 t:時間
②式より、分解が一次反応に従う場合、
時間tに対して反応物の濃度の自然対数(lnC)をプロットすると、
傾きが-k 1の右下がりの直線が得られる。

また、
②式に lnC = 2.303 log10C を代入すると、
時間と濃度の常用対数の関係式として、
次の③式が得られる。

◆ cについて
c 〇 Cの残存量の逆数の対数は、時間と共に直線的に増加する。
薬物Cの分解は2次反応に従う。
2次反応の特徴は下記のリンク先を参照
2次反応とは 速度式,半減期,グラフ
分解が2次反応に従う薬物の濃度(含量)の逆数と時間の関係式として、
次式が成り立つ。

◆ dについて
d × いずれの薬物も、その初濃度と半減期が同じ場合、半減期以降での薬物の分解量の最も少ないのはAである。
分解開始時の初濃度と半減期がA~Cで同じ場合、
半減期以降での薬物の分解量について、
分解量の少ないものから、
C(2次反応)→ B(1次反応) → A(0次反応)
となる。
以下、詳細
0次、1次、2次の各反応の
半減期(t1/2)の特徴は下記の通り。
・0次反応の半減期
上式より、0次反応の半減期は初濃度に比例する。
・1次反応の半減期
上式より、1次反応の半減期は初濃度に無関係で一定である。
・2次反応の半減期
上式より、2次反応の半減期は初濃度に反比例する。
以上のことから、
分解開始時の初濃度と半減期がA~Cで同じ場合、
半減期以降での薬物の分解量について、
分解量の少ないものから、
C(2次反応)→ B(1次反応) → A(0次反応)
となる。
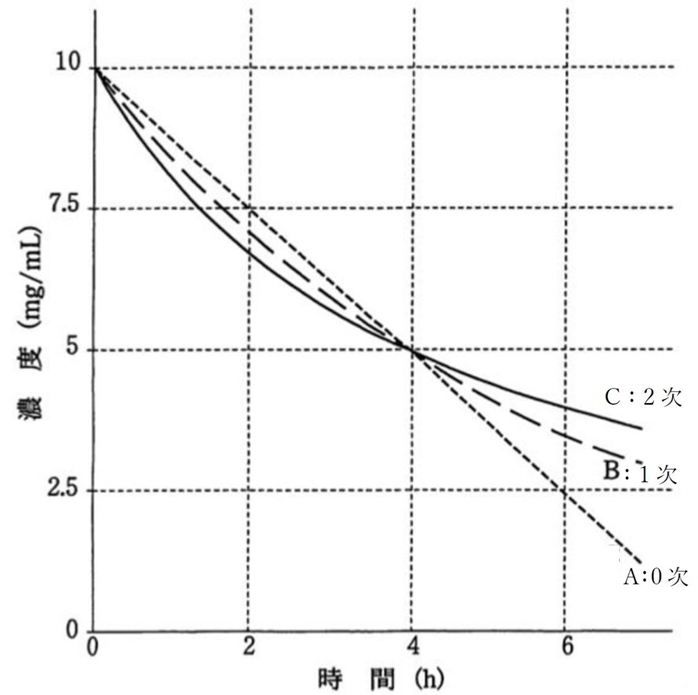
下の図はA~Cについて、
分解開始時の初濃度が10mg/mL,半減期が4時間で等しい場合の
時間に対する濃度の推移を示したグラフである。

半減期以前では、
分解の反応速度は、速いものから、
C(2次反応)→ B(1次反応) → A(0次反応)
であり、
半減期以降では、
分解の反応速度は、速いものから、
A(0次反応)→ B(1次反応) → C(2次反応)
である。