96回薬剤師国家試験問22 0次反応の反応速度定数の次元
96回薬剤師国家試験 問22
化学反応に関する記述のうち、正しいものはどれか。
a 0次反応の反応速度定数の次元は、濃度・時間-1である。
b 可逆反応において、正反応と逆反応の反応速度定数は常に等しい。
c 触媒の添加で反応速度が大きくなるのは、反応の活性化エネルギーが低下するからである。
d 活性化エネルギーが大きいと、その化学反応は吸熱反応となる。
96回薬剤師国家試験 問22 解答解説
◆ aについて
a 〇 0次反応の反応速度定数の次元は、濃度・時間-1である。
反応速度定数kの次元を知るには、
微分型速度式をk=○○の式に変換すればよい。
0次反応の微分型速度式は次式で表される。

上式より、
0次反応の反応速度定数kの次元は、
濃度・時間-1だとわかる。
◆ bについて
b × 可逆反応において、正反応と逆反応の反応速度定数は常に等しい。
可逆反応において、正反応と逆反応の反応速度定数が常に等しいとは限らない。
下記に示すAとBによる可逆反応を考える。

平衡状態では、正反応と逆反応の反応速度は等しくなり、
次式が成り立つ。

可逆反応において、平衡状態では正反応と逆反応の反応速度は等しいが、
反応速度定数が等しいとは限らない。
◆ cについて
c 〇 触媒の添加で反応速度が大きくなるのは、反応の活性化エネルギーが低下するからである。
詳細は下記のリンク先を参照
触媒の添加と活性化エネルギー・反応速度 82回問27cd
◆ dについて
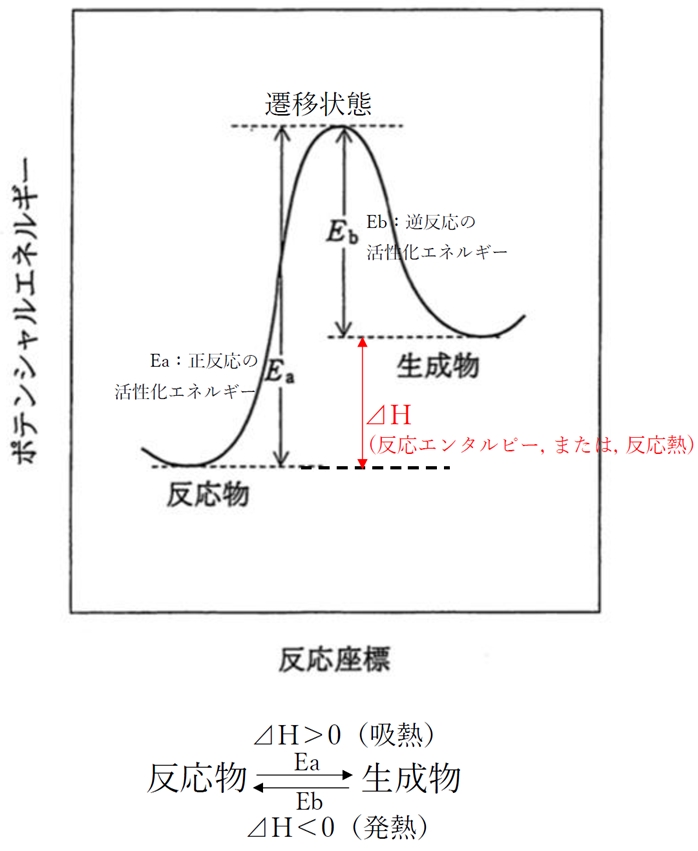
d × 活性化エネルギーが大きいと、その化学反応は吸熱反応となる。
化学反応が発熱反応か吸熱反応かを決定づけるのは、
反応エンタルピー(反応熱:⊿H)の符号の正・負であり、
活性化エネルギーの大・小ではない。
反応前の系より反応後の系の方がエネルギーが高く、
反応エンタルピー(反応熱:⊿H)が正の値である場合、
正反応は吸熱反応である(⊿H>0で吸熱反応)
下のエネルギー図は、
正反応(右方向)は⊿H>0で吸熱反応であり、
逆反応(左方向)は⊿H<0で発熱反応である。
詳細は下記のリンク先を参照
発熱反応・吸熱反応のエネルギー図