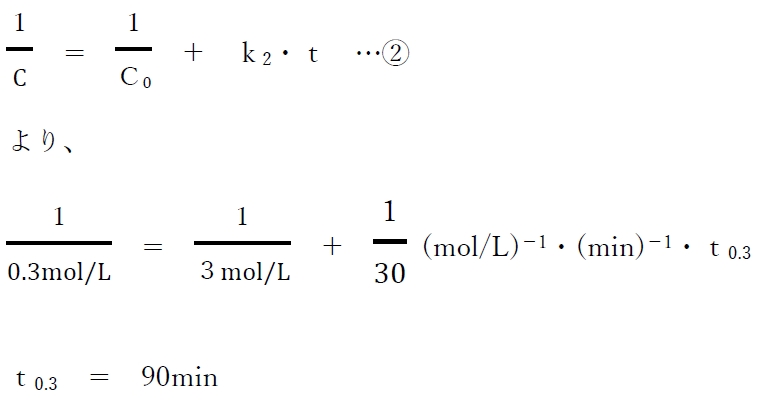89回薬剤師国家試験問23 化合物Aが90%分解するのに要する時間
89回薬剤師国家試験 問23
次の文章の〔 〕に入る数値の正しい組合せはどれか。
化合物Aの200 ℃での分解反応の半減期は初濃度が1 mol/Lの時は30分、2 mol/Lの時は15分であった。この分解反応は0次、1次、2次反応のうち〔 a 〕次反応に従って分解し、初濃度が3 mol/Lの場合、化合物Aが90%分解するのに要する時間は〔 b 〕分である。

89回薬剤師国家試験 問23 解答解説
正解は3(a:2 b:90)である。
「この分解反応は0次、1次、2次反応のうち〔a:2〕次反応に従って分解し、初濃度が3 mol/Lの場合、化合物Aが90%分解するのに要する時間は〔b:90〕分である。」
◆ aについて
問題文に「化合物Aの200 ℃での分解反応の半減期は初濃度が1 mol/Lの時は30分、2 mol/Lの時は15分であった」とある。
Aの半減期は初濃度に反比例することから、
Aの分解は二次反応に従うと考えられる。
2次反応については下記のリンク先を参照
2次反応の特徴 速度式,半減期,グラフ
◆ bについて
Aの分解は二次反応に従うことから、
Aの半減期(t1/2)について、次の①式が成り立つ。

問題文に「Aの半減期は初濃度が1mol/Lの時は30分」とあるので、
①式に数値を代入し、
k2について解くと、

本問では、
初濃度が3 mol/Lの場合で、
化合物Aが90%分解するのに要する時間を求めるが、
それは、
初濃度が3 mol/Lで、
濃度が0.3mol/Lになるのに要する時間(t0.3)を求めることになる。
分解が2次反応に従う場合、
濃度の逆数1/Cと時間tの関係式として、
次の②式が成り立つので、
数値を代入してt0.3について解く。