塩基性度の強さの比較 総合問題 薬剤師国家試験93回問4②
第93回薬剤師国家試験 問4②
下記のA~Dについて、塩基性度の最も大きいものと最も小さいものを挙げなさい。
A. aniline
B. pyrrolidine
C. indole
D. pyridine
第93回薬剤師国家試験 問4の2 解答解説

塩基性度の最も大きいものはB. pyrrolidine
塩基性度の最も小さいものはC. indole
物質同士の塩基性の比較のポイントを下記の①~④で示す。
① 環の窒素の非共有電子対がp軌道に収容され、環の芳香族性に寄与している場合、その窒素は塩基性を示さない

Cのインドールでは、窒素の非共有電子対がp軌道に収容されることで、環は芳香族性を示し、結果、環は安定なものになっている。よって、Cのインドールは塩基性を示さない。
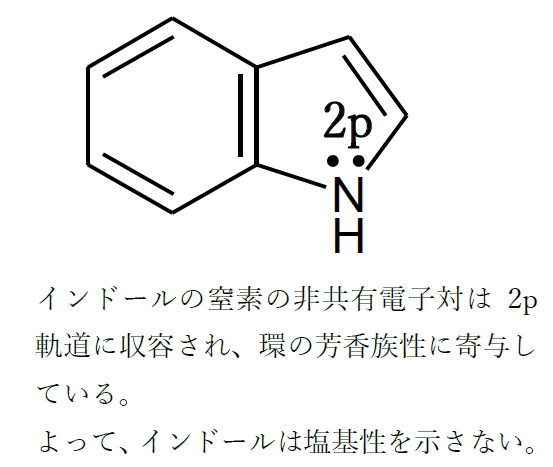
② 非共有電子対が共鳴により非局在化すると塩基性が弱くなる。
詳細は下記のリンク先を参照
脂肪族アミンと芳香族アミンの塩基性の比較 89回問4の1

Aのように芳香環に直接アミンが置換しているものを芳香族アミンと呼ぶ。
脂肪族アミンと芳香族アミンの塩基性度の比較では、
脂肪族アミン > 芳香族アミン
である。
芳香族アミンや共役系のように窒素の非共有電子対が共鳴により非局在化する場合は、非共有電子対が供与されにくいので塩基性が弱いことを押さえておこう。
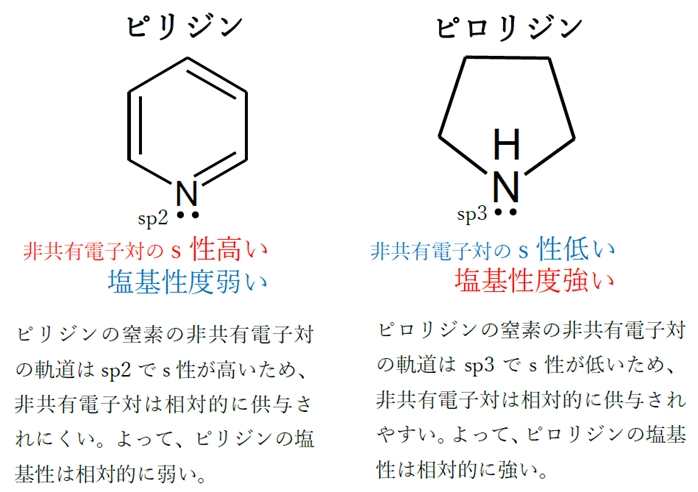
③ 非共有電子対が入る混成軌道のs性が低いほど塩基性が強い。
詳細は下記のリンク先を参照
非共有電子対の軌道と塩基性 82回問2ab
非共有電子対が入る軌道のs性と塩基性の高さについて、
塩基性の強いものから、sp3>sp2>spとなる。
これを踏まえ、BのピロリジンとDのピリジンの塩基性の比較を行う。
Bのピロリジンの窒素の非共有電子対はsp3に入っているので塩基性が比較的強い。
Dのピリジンの窒素の非共有電子対はsp2混成軌道に入っているので塩基性が比較的弱い。
④ 窒素にアルキル基が結合すると電子供与性電子効果により塩基性が強くなる。
アルキル基は電子供与性の誘起効果を与える。供与可能な非共有電子対を持つ窒素にアルキル基が結合すると、アルキル基の電子供与性電子効果により窒素の電子密度が高まり非共有電子対を供与しやすくなることから、窒素の塩基性が強まる。
ピロリジンでは、窒素に2つのアルキル基が結合しているとみなせる。

よって、ピロリジンでは、アルキル基による電子供与性電子効果で、供与可能な非共有電子対を持つ窒素の電子密度が高まり、窒素の塩基性は強いと考えられる。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)