電荷の同じイオンのイオン交換の比較 イオン交換平衡定数と水和イオン半径の関係 物理系薬学
本ページでは、電荷の同じイオン同士のイオン交換の比較について、
イオン交換平衡定数とイオン半径の関係について説明しています。
電荷が同じイオン同士のイオン交換体への結合力の比較では、
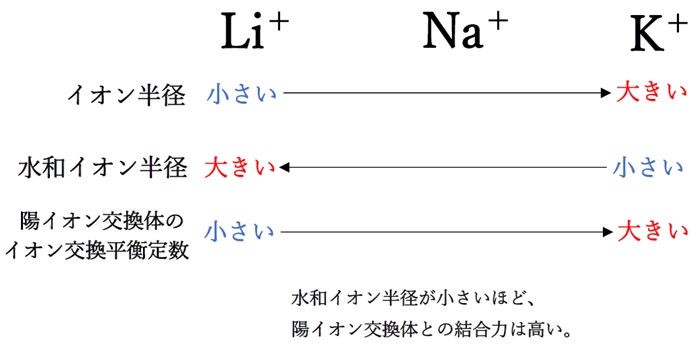
水和イオン半径が小さいほど、イオン交換体に保持されやすい(イオン交換平衡定数が大きい)。
イオン半径が大きいほど、水和イオン半径は小さい。
例として、
正電荷数が1であるLi+,Na+,K+の陽イオン交換体のイオン交換平衡定数の比較について述べる。
イオン半径は、K+>Na+>Liであり、
水和イオン半径は、K+<Na+<Liである。
水和イオン半径が小さいほど、
陽イオン交換体に保持されやすい(イオン交換平衡定数が大きい)ので、
陽イオン交換体のイオン交換平衡定数が大きい順に
K+>Na+>Liとなる。